Le neoplasie cutanee sono i tumori maligni che vengono diagnosticati più frequentemente nella popolazione bianca con un’incidenza di circa 1.4 milioni di nuovi casi all’anno. Durante la propria vita un individuo su 5 nato nel 2004 svilupperà un tumore cutaneo. Più della metà di tutte le neoplasie diagnosticate nella popolazione bianca sono tumori cutanei.
La tipologia dei tumori cutanei più frequenti sono il carcinoma/epitelioma basocellulare e lo spinocellulare (BCC e SCC).
Il melanoma rappresenta il 4% di tutte le diagnosi di tumore cutaneo ma è responsabile del 75% delle morti dovute a tumore della pelle, con circa il 20% di decessi legati ai pazienti che ne vengono colpiti.
Circa 12-13.000 casi di melanoma verranno diagnosticati in Italia ogni anno, con una lieve prevalenza di individui di sesso maschile. Questo è il risultato di un aumento di incidenza di nuovi casi di melanoma del 4% per anno. Nella popolazione caucasica l’incidenza di melanoma è aumentata più di 3 volte tra il 1980 e il 2003. Il melanoma invasivo rappresenta la quinta neoplasia più comune nell’uomo e la settima più comune nelle donne, mentre rappresenta la forma più comune di tumore maligno nelle donne tra i 25 e i 29 anni. È fondamentale considerare che la diagnosi precoce e il trattamento chirurgico corretto di queste neoplasie cutanee può portare alla guarigione l’80% dei pazienti.
IL MELANOMA
Prevenzione dai primi anni di vita
Il melanoma è un tumore cutaneo che deriva dalla trasformazione maligna dei melanociti (le cellule che normalmente determinano la pigmentazione della pelle mediante la sintesi della melanina).
Può insorgere su cute apparentemente sana oppure dalla modificazione di un neo (o nevo) preesistente. L’incidenza di questa neoplasia è in netto aumento in tutto il mondo. Infatti, negli ultimi quindici anni, il numero di casi di melanoma è praticamente raddoppiato.
Gli studi epidemiologici che si occupano di correlare le malattie con i possibili fattori di rischio da molti anni puntano il dito sul ruolo del sole nell’insorgenza del melanoma, ma il rapporto tra quantità di esposizione solare ed insorgenza di questo tumore non è lineare.
In realtà si è osservato che le persone che lavorano all’aria aperta presentano una incidenza inferiore di chi lavora in ufficio e si espone al sole in modo eccessivo per brevi periodi (vacanze) durante l’anno. In Europa inoltre il melanoma è più frequente al nord che al sud. E’ noto da tempo che una eccessiva esposizione solare durante l’infanzia può condizionare lo sviluppo del melanoma dopo molti anni, (malattia tipicamente dell’età adulta) e ma anche l’eccessiva esposizione solare risulta dannosa negli adulti. Studi epidemiologici hanno inoltre dimostrato che il numero dei nei dei bambini è direttamente correlato con la quantità di esposizione solare e si sa che il melanoma si sviluppa più frequentemente nelle persone con molti nei.
Gli individui che più frequentemente sviluppano il melanoma sono i soggetti con carnagione chiara, capelli rossi o biondi, occhi chiari, con molti nevi atipici.
Per fare una corretta prevenzione nei bambini il messaggio educativo deve essere orientato soprattutto ai genitori che portano i bambini al sole, in particolare nei primi anni della loro vita in modo da proteggerli in maniera adeguata. Prima dei sei mesi un bambino non dovrebbe mai essere esposto al sole allo scopo di ottenerne l’abbronzatura.
Nei primi anni di vita i bambini dovrebbero evitare l’esposizione al sole nelle ore centrali della giornata e se questo non fosse attuabile, occorre proteggerli con maglietta e cappellino, ma la maglietta di cotone non va indossata se bagnata in quanto non più in grado di filtrare i raggi ultravioletti. A questo scopo ci sono tessuti ad hoc che permettono ai bambini di fare il bagno e poi restare esposti al sole con una protezione ottimale della cute. I Australia tali indumenti sono molto utilizzati nelle spiagge. Le creme solari possono essere impiegate ma non sostituiscono maglietta e cappellino.
Le creme solari devono avere una protezione caratterizzata da un filtro di tipo fisico e chimico ed è utile applicarle soprattutto all’inizio dell’esposizione solare, quando la cute, non ancora abbronzata, presenta un elevato rischio di scottature. Non devono invece essere assolutamente usate per prolungare l’esposizione al sole.
Per quanto riguarda la prevenzione in età adulta bisogna comunque evitare una eccessiva esposizione solare in modo da non creare problematiche di fotodanneggiamento della cute e causare un precoce invecchiamento cutaneo caratterizzato tipicamente da rughe e macchie o cheratosi attiniche, ma è soprattutto fondamentale impegnarsi soprattutto nella diagnosi precoce. Il suggerimento che si consiglia è quello di sottoporsi ad una visita di controllo dei nei quando, per qualsiasi motivo, ci si recasse dal proprio medico di famiglia. Quest’ultimo sarà in grado di suggerirvi una eventuale visita specialistica se lo dovesse ritenere opportuno. In Italia si può anche richiedere direttamente una visita dei nei da uno specialista, per cui la gran parte degli individui dovrebbe organizzarsi in tal senso una volta all’anno se le caratteristiche della sua cute lo richiedessero. Comunque generalmente consigliamo un controllo clinico annuale dei nei se, chiaramente, non ci fossero problematiche particolari. E’ infatti ben documentato che il melanoma è guaribile con una corretta e tempestiva asportazione chirurgica quando la diagnosi avviene in una fase iniziale.
L’utilizzo di creme ad elevato fattore protettivo è indicato se si utilizza un prodotto ad alta protezione, sia per gli UVB sia per gli UVA, in associazione con altri strumenti (comportamentali) di fotoprotezione come evitare l’esposizione nelle ore centrali della giornata, indossare il più possibile maglietta, cappello ed occhiali.
L’utilizzo corretto dei prodotti di protezione solare non può prescindere da un adeguato comportamento in relazione all’esposizione al sole.
Eziologia e fattori di rischio
Sono numerosi i fattori di rischio ambientali e genetici che vengono implicati nello sviluppo del melanoma cutaneo.2 Tra i fattori di rischio si annoverano l’esposizione alla luce ultravioletta (UVL), un complesso di caratteristiche tra cui cute chiara e incapacità ad abbronzarsi, occhi azzurri o verdi, capelli biondi o rossi, lentiggini, una storia di cheratosi attiniche o di tumori cutanei non melanoma, una anamnesi di scottature con vesciche o disepitelizzazione, immunosoppressione, una storia familiare o personale di melanoma, la presenza di una mutazione CDKN2A/p16/NC1R, la presenza di xeroderma pigmentoso, nevi atipici (displastici), più di cento nevi cutanei e la presenza di nevo gigante melanocitico congenito. I pazienti con un’importante storia di esposizione solare sono particolarmente ad alto rischio, specialmente se hanno riscontrato episodi di disepitelizzazioni o vesciche dopo scottature, in particolare sia prima che dopo i 20 anni. Il melanoma colpisce raramente individui di colore, suggerendo che la cute pigmentata giochi un ruolo protettivo e tali individui di colore nero o di origine asiatica presentano una maggior incidenza di melanoma palmo plantare che non cutaneo. L’incidenza del melanoma è soggetta ad una significativa variabilità geografica ed etnica, in particolare in quanto presenta una correlazione inversa con la latitudine e il grado di pigmentazione della pelle. Le popolazioni di origine anglosassone di pelle chiara residenti vicino all’equatore hanno un’incidenza maggiore di melanoma, al contrario ad esempio di quanto accade in Italia. Certamente l’esposizione ai raggi ultravioletti del sole o artificiali rappresentano il fattore di rischio più conosciuto. Comunque l’esposizione ai raggi ultravioletti non è la causa di tutti i melanomi, potendo insorgere in aree della nostra pelle assolutamente non fotoesposte.
Sono a rischio gli individui adulti con più di 100 nevi con aspetto normale, i bambini con più di 50 nevi con aspetto normale e ogni paziente di melanoma con nevi atipici o displastici. La storia precedente di melanoma posiziona un paziente in una fascia di rischio più elevato con un 5-10% di individui che sviluppano un secondo melanoma primario. Questo rischio di sviluppare un secondo melanoma primario dura tutta la vita e può manifestarsi in qualunque area della pelle. Per questo motivo un follow-up che duri tutta la vita è generalmente consigliato nei paziente che abbiano avuto un melanoma.
Trasmissione genetica del rischio e Familiarità
Una componente genetica può essere implicata nella patogenesi del melanoma. Tra i pazienti con melanoma, tra il 10% e il 15% presentano una storia familiare positiva. La mutazione genetica più frequentemente associata con il melanoma si caratterizza dal CDKN2A, conosciuto anche come p16. Ad ogni modo la mutazione genetica viene riscontrata soltanto in una piccola percentuale di casi di melanoma caratterizzandosi circa nello 0.2%. La mutazione genetica MC1R è chiaramente un fattore di rischio per il melanoma cutaneo. La combinazione della mutazione MC1R e la presenza di capelli rossi è associata con un rischio molto alto di sviluppo di melanoma. Inoltre la mutazione MC1R R151C si ritiene modifichi l’effetto di un altro gene di suscettibilità per il melanoma, il CDKN2A. L’eziologia genetica del melanoma rappresenta un’area di futura ricerca.
L’ereditarietà del melanoma cutaneo viene descritta sin dagli anni ’70. Si segnalarono gli individui caratterizzati dalla “B-K Mole Syndrome”, il cui acronimo origina dalle iniziali due famiglie caratterizzate dalla presenza di nevi acquisiti di dimensioni aumentate con caratteristiche di irregolarità e displasia, spesso presenti in aree della cute non esposte a raggi ultravioletti come il cuoio capelluto e tronco. Durante quegli anni, Lynch et al.5 descrissero indipendentemente un’associazione familiare di melanoma tra individui con nevi atipici, che venne chiamata “Familiar Atipical Multiple Mole Melanoma Syndrome” (FAMMMS), con la presenza di trasmissione autosomica dominante. Il rischio di sviluppare un melanoma quindi nell’arco di 10 anni in una situazione di sindrome di nevi atipici è descritta intorno al 10.7% contro uno 0.62% nei gruppi di controllo. Green et al.6 stimano un rischio totale tra i 20 e i 59 anni pari al 56% e del 100% entro i 76 anni negli individui con la sindrome del nevo atipico. La presenza di un nevo atipico non rappresenta una pre-cancerosi ma un marker genetico di aumentato rischio di sviluppo del melanoma, che può avvenire in qualsiasi area della superficie cutanea incluse le zone protette dal sole. Infatti più del 50% -75% dei melanomi si sviluppano de novo da aree di cute normale, non da preesistenti lesioni cutanee.
Lo xeroderma pigmentoso (XP) è una rara malattia autosomica recessiva associata con una ridotta o assente capacità di riparazione del DNA danneggiato dai raggi ultravioletti. Pertanto questa alterazione porta allo sviluppo di molteplici tumori cutanei maligni incluso il melanoma ma anche i carcinomi basocellulari e spinocellulari. In questi individui il primo tumore cutaneo viene diagnosticato prima dei 10 anni. Sfortunatamente lo sviluppo dei tumori cutanei è indolente.
Nevi congeniti e nevi congeniti giganti
I nevi congeniti melanocitici (CMN) sono presenti alla nascita o compaiono entro i primi 6 mesi.
Si calcola che dal 1% al 6% dei bambini nascano con CMN. Queste lesioni melanocitarie sono classificate in base al loro diametro. Vengono classificate come piccole lesioni quelle che misurano meno di 1.5 cm e rappresentano la maggioranza di esse. Le lesioni di medie dimensioni misurano tra 1.5 cm e 19.9 cm. Le lesioni di grandi dimensioni, o anche chiamate nevi congeniti giganti, misurano più di 20 cm. Queste grandi dimensioni possono portare a problematiche importanti dal punto di vista sia cosmetico che psicologico. Il rischio di sviluppo di un melanoma dal nevo congenito melanocitico di piccole dimensioni è simile a quello di qualsiasi altra area della cute con nevi acquisiti. Lo sviluppo di un melanoma da un CMN generalmente avviene dopo l’età pediatrica e prende origine dalla giunzione dermo-epidermica permettendo quindi una diagnosi precoce relativamente semplice. La rimozione profilattica di piccoli CMN non è generalmente indicata in assenza di segni o sintomi di tipo evolutivo o di modificazioni in genere. Al contrario CMN medi o giganti presentano un aumentato rischio per il melanoma con una percentuale variabile dal 5 al 15%. Nell’ambito dei CMN giganti che si trasformano in melanoma, circa il 70% vengono diagnosticati prima dei 30 anni di età. Il melanoma può originare dallo strato profondo dell’epidermide nei CMN giganti e spesso queste lesioni hanno un elevato ispessimento della cute che diventando ricca di peli ne rende particolarmente difficoltoso il follow up clinico. Conseguentemente, potendo manifestarsi nella parte profonda della cute, la diagnosi nell’ambito di un CMN gigante è più difficoltosa e può avvenire con una lesione primaria più avanzata.
I pazienti con un CMN gigante specialmente se localizzato sul dorso o in contatto con molte altre piccole lesioni satellite sono anche a rischio di una melanocitosi neurocutanea (NCM). 8.9
La NCM è caratterizzata dalla presenza di tumori leptomeningei benigni o maligni. La maggioranza dei pazienti manifestano durante i primi due anni di vita segni neurologici di aumento della pressione intracranica, di effetto massa, o di trasformazione maligna verso il melanoma. Mediante risonanza magnetica nucleare (RM) possono essere individuate lesioni da NCM anche in bambini asintomatici. NCM è associata con l’aumentato rischio di sviluppo di melanoma a livello del sistema nervoso centrale.
Diagnosi clinica demoscopica e con microscopio laser confocale
Un aspetto molto importante nella diagnostica delle lesioni cutanee e’ l’attenzione che deve essere sempre rivolta al quadro clinico generale del paziente, ed alla sua anamnesi con particolare riguardo all’individuazione dei fattori di rischio per il melanoma. Allo stato attuale delle cose non esiste una tecnica diagnostica che combinando in sé il 100% di sensibilita’ e specificita’ permetta di fare una diagnosi certa di melanoma cutaneo. In questo scenario clinico, pertanto, per una diagnosi che sia il piu’ precoce e sensibile possibile, abbiamo a disposizione le seguenti metodiche: l’ABCDE, il segno del brutto anatroccolo, la dermatoscopia, e le metodiche di fotografia digitale computer assistite o mappatura digitale e la microscopia laser confocale. Il risultato finale dell’uso di queste molteplici metodologie diagnostiche e’ quello di una diagnosi piu’ precoce del melanoma con un conseguente miglioramento della sopravvivenza del paziente.
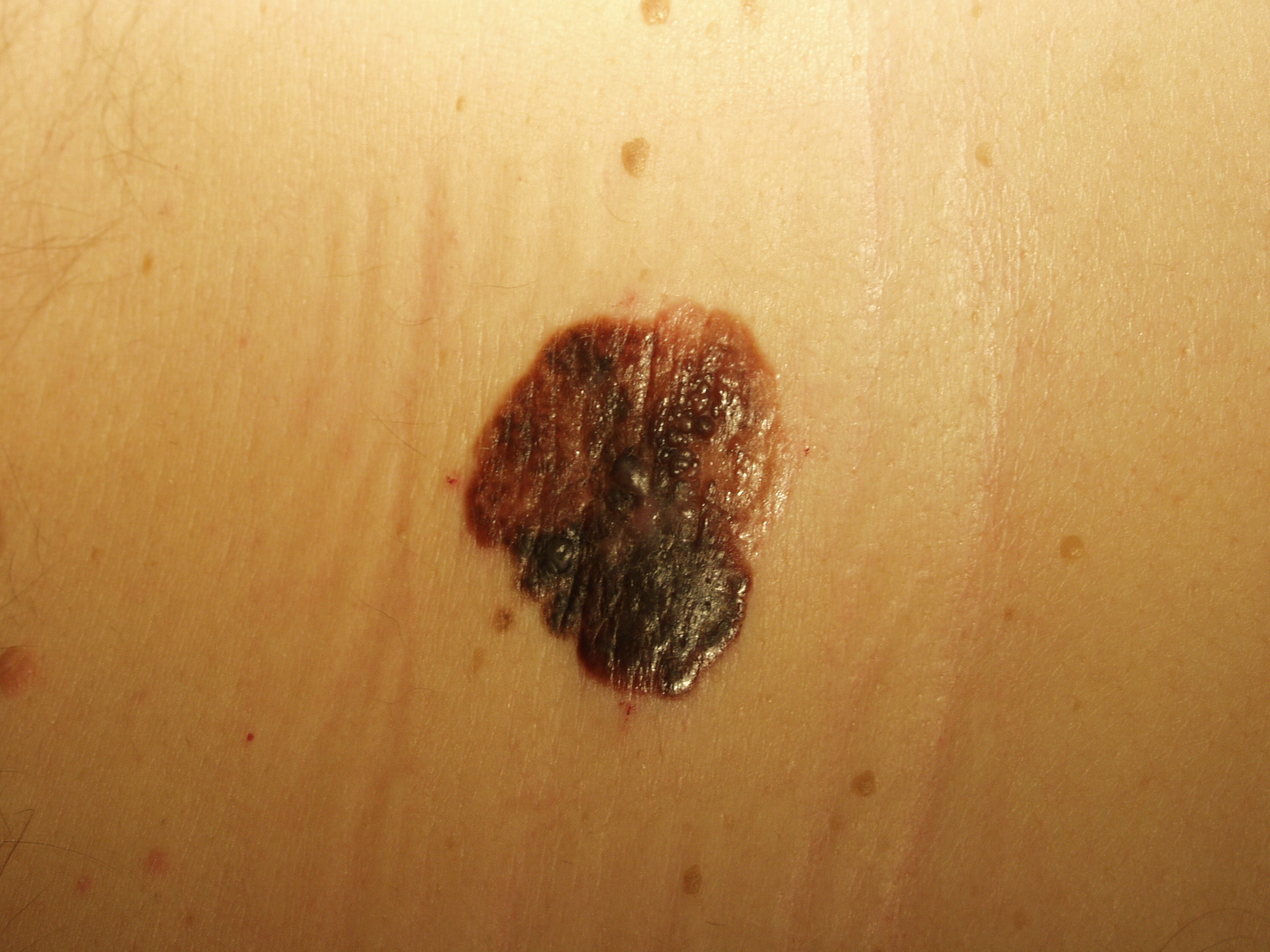
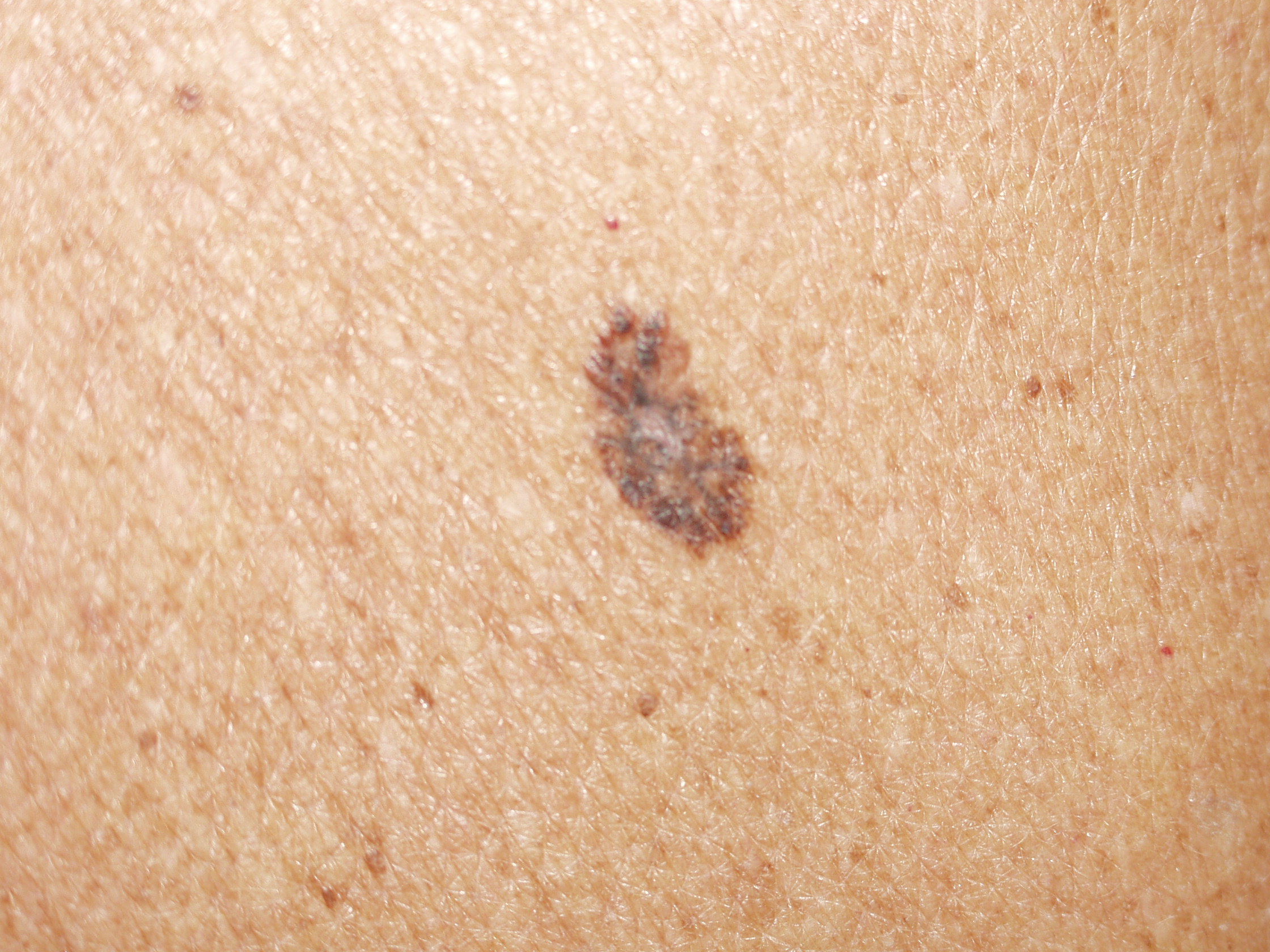
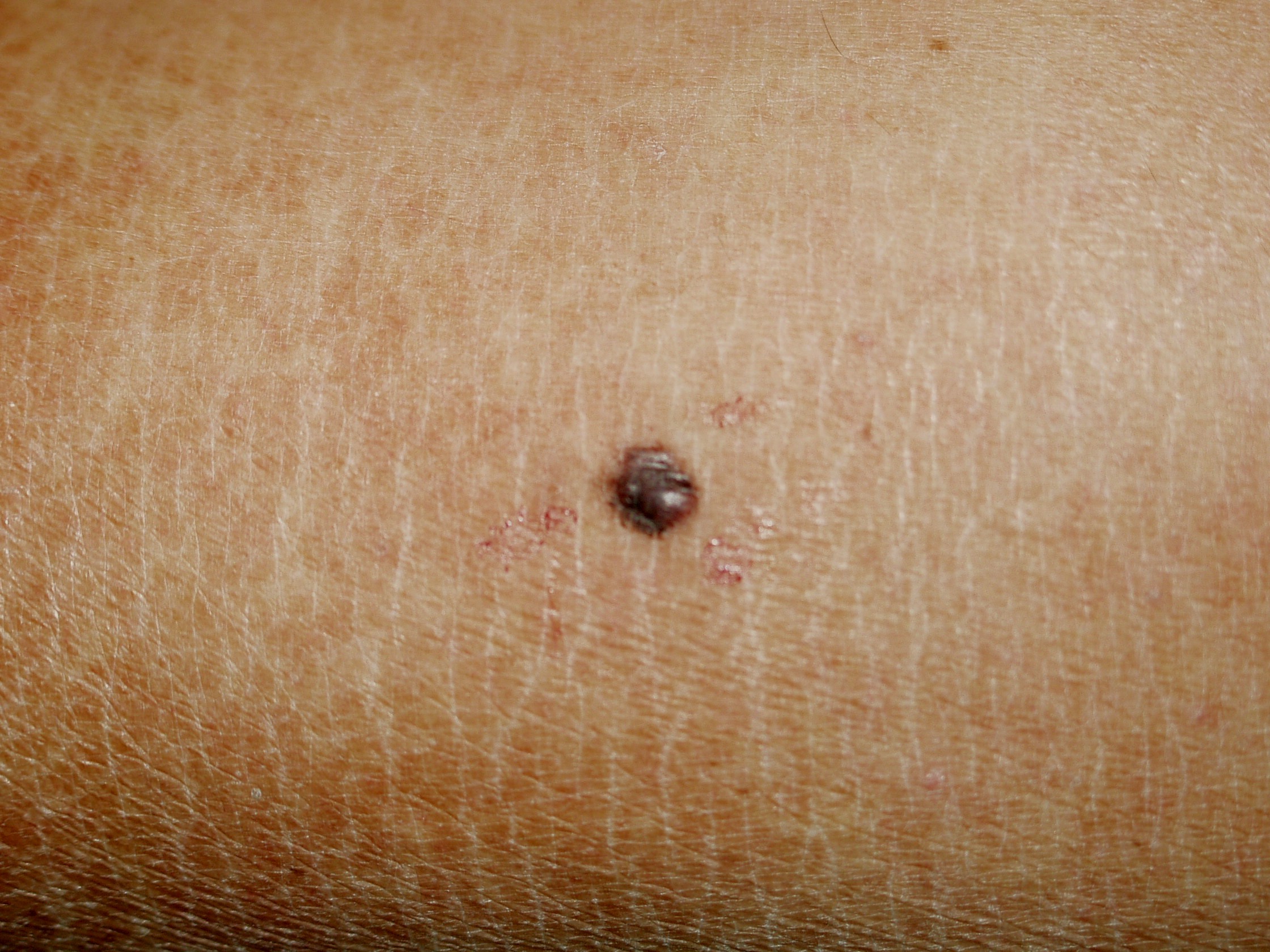
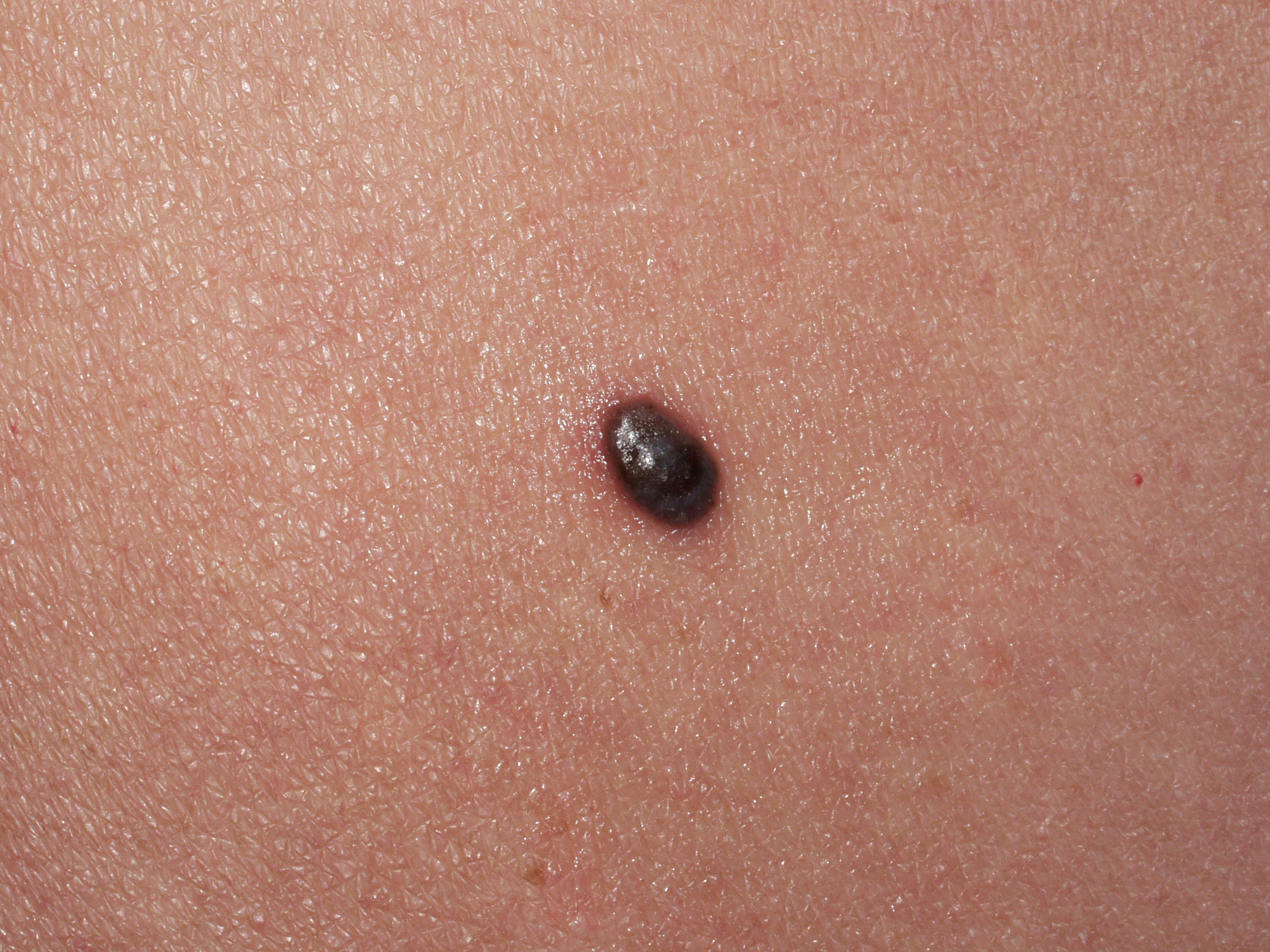
Il melanoma ha generalmente un aspetto caratteristico e la diagnosi precoce è fondamentale. La regola dell’ABCD(E), che sottolinea gli aspetti allarmanti del melanoma è stata descritta decenni fa. La A rappresenta l’Assimetria – metà lesione non corrisponde all’altra metà se noi tracciamo una riga immaginaria lungo il centro della stessa. B sono i bordi generalmente irregolari – i margini sono frastagliati, indentati o sfumati. C rappresenta il colore – la pigmentazione non è uniforme nell’ambito della lesione. Varie tonalità di colore dal marrane scuro al nero o diverse tonalità di rosso, bianco o anche blu possono essere presenti con una caratteristica variabilità. Infine la D rappresenta il diametro – la larghezza maggiore di 6 mm (all’incirca come la gomma di una matita). La “Seven-point check list” usata in Europa include molti degli degli aspetti della regola ABCD con in più anche l’aggiunta delle modificazioni. Un utile aiuto alla diagnosi viene dal “segno del brutto anatroccolo”. La presenza di una lesione pigmentata che sia differente rispetto alle altre dovrebbe essere analizzata con attenzione e con un elevato grado di sospetto. Infine l’ultimo aspetto riguarda la E: evoluzione. Non si deve attendere che un neo manifesti segnali di evoluzione particolarmente evidenti come la crescita sia del diametro che dello spessore o addirittura l’ulcerazione: quando un nevo diventa più scuro o manifesta differenze cromatiche o di margini rispetto al passato deve essere sottoposto alla valutazione dello specialista.
Diagnosi Precoce
La diagnosi precoce è l’obiettivo di ogni supporto alle metodiche diagnostiche, con la capacità di distinguere tra lesione benigne e maligne, e una sensibilità del 100% associata ad una elevata specificità. Le regole dell’ABCDE e del “segno del brutto anatroccolo” sebbene raggiungono un elevata sensibilità non riescono comunque a raggiungere tutti questi criteri in particolare per quanto riguarda la specificità nel distinguere tra un melanoma e una lesione benigna: in sostanza queste metodiche permettono di riconoscere la gran parte dei melanomi, ma la quantità di nei che potrebbero essere scambiati per sospetti pur non essendolo è molto elevata, creando quindi molta preoccupazione inutilmente.
Melanoma difficile da riconoscere
Il criterio dell’ABCD può fallire nell’individuare un importante quota di melanomi nodulari, dato che spesso non sono rappresentati dalla regola dell’ABCD e sono spesso di dimensione inferiore ai 6 mm nelle fasi di precoce individuazione. La regola dell’ABCD è anche relativamente statica senza quell’importante criterio che è rappresentato dal cambiamento. Studi clinici hanno documentato l’importanza della rappresentazione delle modificazioni nella dimensione, nella forma, nel colore e nella precoce e persistente presenza di prurito. Le modificazioni di una lesione rappresentano uno dei migliori metodi per la diagnosi precoce dove potrebbero non essere rappresentati gli altri segnali tipici di un melanoma. Pertanto noi come altri abbiamo utilizzato la D della regola dell’ABCD per presentare la “differenza”. Una differenza o cambiamento della lesione, specialmente per quanto riguarda il diametro, la forma, il colore o la persistenza di prurito necessitano un’attenta valutazione. Oltretutto i nei sul corpo di un individuo dovrebbero essere generalmente simili o essere simili a quelli degli altri membri della famiglia. Se uno dei nei dovesse apparire differente dagli altri dovrebbe essere analizzato con un elevato grado di sospetto.
Inoltre, se tutti i nevi sono atipici od irregolari, ma morfologicamente simili tra di loro e senza pregresse modificazioni di forma e colore, non c’e’ motivo di preoccupazione nei riguardi di un singolo nevo trattandosi di un quadro clinico di nevi atipici o displastici. In ogni caso, la presenza di nevi atipici rappresenta un importante fattore di rischio nei confronti del melanoma che, in questi casi, si puo’ sviluppare con la stessa frequenza sia sulla pelle sana, sia a partire da nevi normali o displastici. Inoltre, poiche’ l’asportazione di tutti i nevi atipici influisce ben poco nella prevenzione del melanoma, diviene di fondamentale importanza l’educazione del paziente che deve evidenziare lui stesso il piu’ precocemente possibile le loro modificazioni.
Classificazioni istologiche
In base alle caratteristiche istologiche e cliniche possiamo classificare il melanoma in quattro tipi: lentigo maligna melanoma (LMM), melanoma a diffusione superficiale (SSM), melanoma nodulare (NM) e melanoma oro-acrale lentigginoso (ALM).11 La prognosi di ognuno di questi sottotipi correla direttamente con lo spessore di Breslow non essendoci fattori prognostici specifici per i singoli sottotipi. La LMM rappresenta dal 10% al 15% dei melanomi ed e’ tipica delle persone anziane nelle zone cronicamente foto esposte della testa e del collo. Il pattern clinico della LMM e’ caratterizzato da un’alta percentuale di crescita non evidente ad occhio nudo estesa asimmetricamente oltre la lesione clinicamente evidente. La LMM spesso si presenta inizialmente come una lesione pianeggiante di colore marrone in un’area del corpo esposta cronicamente ai raggi solari. La sua evoluzione nel tempo e’ caratterizzata da un viraggio del colore verso il nero e dall’acquisizione di tutte le altre caratteristiche morfologico/cliniche del melanoma. L’exeresi della lesione deve essere completa con un controllo assoluto dei margini che devono essere in territorio sano, poiche’ se questo non accadesse, avremmo un tasso piu’ alto di recidiva con un peggioramento della prognosi. Inoltre dobbiamo anche considerare che il melanoma amelanotico e quello desmoplastico con neurotropismo sono molto piu’ frequenti nella lentigo maligna rispetto agli altri sottotipi.
La Lentigo maligna (LM) non e’ una lesione benigna, come ritenuto per un lungo periodo di tempo, ma rappresenta invece un melanoma in situ con possibile progressione nel tempo verso la forma invasiva della LMM.
Il SSM rappresenta circa il 70% di tutti i melanomi della cute. Il suo pattern e’ il piu’ comune fra i melanomi poiche’ si sviluppa a partire da un nevo gia’ presente. Il SSM e’ tipicamente caratterizzato da variazioni di colore, forma, e bordi irregolari, e quindi sostanzialmente si presenta con le classiche atipie morfologiche del melanoma.
Il NM rappresenta dal 15% al 30% dei melanomi ed e’ il piu’ aggressivo dei quattro sottotipi a causa spesso di una ritardata diagnosi e di una rapida crescita. In linea generale questo melanoma presenta un colore piu’ uniforme rispetto agli altri tipi, i bordi sono regolari e nelle forme precoci, il diametro e’ inferiore a 6 mm, cosicche’ all’inizio mancano gli aspetti tipici del melanoma; per tale motivo la valutazione di tutti questi aspetti e’ di fondamentale importanza per una diagnosi accurata e precoce.
Il melanoma oro-acrale lentigginoso (ALM) e’ una variante del melanoma che nella maggior parte dei casi compare nelle mani, nei piedi, nelle dita, ed anche in sede sottoungueale. La percentuale del ALM varia a seconda della razza, infatti rappresenta dal 2% all 8% dei melanomi nei caucasici ma la sua percentuale di incidenza sale drammaticamente dal 35% al 60 % nelle razze con pelle nera o gialla. Questo tipo di melanoma ha spesso una diagnosi tardiva e cio’ e’ dovuto al fatto che compare in una posizione anatomica che spesso non viene esaminata e, almeno inizialmente, non ha caratteristiche precipue del melanoma. La sua prognosi e’ simile a tutti gli altri sottotipi di melanoma quando viene correlato con lo spessore di Breslow. Quando il ALM compare nella sede sottoungueale ha l’ aspetto di una sottile ed irregolare stria rossiccia che origina dalla base del letto ungueale. Piu’ dei tre quarti di questo tipo di melanoma compare sul pollice o sull’alluce, e molto spesso il problema e’ rappresentato dalla diagnosi differenziale con l’ematoma sottoungueale da cui la distinzione è spesso semplice in mani esperte: una tipologia di manifestazione tipica delle forme iniziali è infatti la presenza di melanonichia, cioè di una striscia verticale di pigmento che origina dalla matrice e raggiunge il bordo dell’unghia: tale melanoma cosiddetto dell’unghia in realtà non si trova al di sotto della lamina ungueale ma insorge in corrispondenza della matrice dell’unghia.
Gli altri tipi di melanoma sono assai rari, tuttavia meritano un breve accenno. Il melanoma delle mucose, anale, e vulvovaginale sono associati con una prognosi assai sfavorevole e questo perche’ spesso sono in uno stadio avanzato all’atto della diagnosi in quanto comparsi in parti del corpo difficilmente accessibili. Il melanoma desmoplastico si correla con un’alta percentuale di neurotropismo e di recidiva locale. Il melanoma a piccole cellule o melanoma nevoide nella maggior parte dei casi non ha il classico aspetto del melanoma per questo motivo la diagnosi e’ assai difficile e spesso, almeno inizialmente, non viene riconosciuto determinando in questa maniera un importante ritardo diagnostico. Il melanoma amelanocitico rappresenta il 3%-4% di tutti i melanomi ed e’ caratterizzato da una diagnosi molto ritardata dovuta alla perdita del pigmento.
Vi sono infine nuove tipologie descrittive coniate dai patologi spesso di non facile definizione. Un problema interpretativo in questo campo è il fatto che alcune lesioni melanotiche hanno caratteristiche morfologiche e biologiche intermedie fra il nevo e il melanoma, e che pertanto non possono essere collocate con precisione né in una categoria né in un’altra. Diagnosi quali “nevo displastico”, “nevo di Spitz atipico”, “neoplasia melanocitica spitzoide atipica”, “melanoma a deviazione minima”, “melanocitoma” e “tumore melanocitico a potenziale di malignità incerto (abbreviato con l’acronimo MELTUMP)” sono a volte usate dall’anatomopatologo per esprimere i problemi diagnostici creati da queste lesioni: il SAMPUS proliferazione melanocitica superficiale atipica ad incerto significato e il MELTUNP ne sono il classico esempio, a cui si associano il Tumore di Spitz (o nevo di Spitz atipico) ed il nevo Blu (cellulato) atipico.
Stadiazione e fattori prognostici
Abbiamo a disposizione una gran messe di informazioni riguardo i vari fattori che correlano con una prognosi favorevole del paziente con melanoma. Alcuni di questi fattori prognostici, come la microstadiazione e la forma nodulare, hanno un significato prognostico sufficientemente indipendente da poter essere inseriti in un sistema di stadiazione con una ben conosciuta percentuale di sopravvivenza. Altri di questi fattori, come l’ulcerazione e la forma nodulare microscopica versus macroscopica, sono stati individuati come fattori che possono influenzare la percentuale di sopravvivenza e sono stati inseriti nel sistema di stadiazione.
Microstaging
Uno dei piu’ importanti fattori prognostici del melanoma della cute e’ rappresentato dallo stadio del tumore primario. Il metodo di microstadiazione usato correntemente fu proposto da Breslow. Questa metodica classifica il tumore primitivo in base al suo spessore espresso in millimetri mediante misurazione con un micrometro dall’apice dello strato granulare fino alla base del tumore. Molti studi hanno dimostrato una correlazione fra lo spessore del tumore e la sopravvivenza. Il piu’ ampio studio di oltre 30.000 pazienti fu fatto da American Joint Cancer Commission ed e’ riportato il risultato della valutazione della storia clinica di tutti i pazienti inseriti in un data base mondiale. La presenza di ulcerazione e la percentuale di mitosi sono altri due fattori indipendenti che vengono utilizzati per determinare la microstadiazione del melanoma primitivo. Prima del metodo di microstadiazione di Breslow erano utilizzati i livelli di Clark, che in base all’invasione degli strati della cute era diviso in cinque livelli (I: melanoma in situ, V: invasione dello strato sottocutaneo). Molteplici studi hanno dimostrato che lo spessore di Breslow fornisce informazioni prognostiche molto piu’ accurate rispetto ai livelli di Clark.
La presenza di metastasi ai linfonodi regionali e’ associata ad una prognosi peggiore. La presenza di micrometastasi o metastasi massive ai linfonodi correla in maniera inversamente proporzionale alla sopravvivenza. La sopravvivenza a cinque anni dei pazienti con metastasi ai linfonodi regionali varia dal 70% al 25% in rapporto alle caratteristiche del tumore primitivo ed alla presenza di ulcerazione. L’introduzione della tecnica della biopsia del linfonodo sentinella (LBS) ha identificato un sottogruppo di pazienti con micrometastasi al linfonodo sentinella che hanno una prognosi molto migliore rispetto ai pazienti con metastasi massive. Anche questi parametri sono stati inseriti nel sistema di stadiazione.
Staging Clinico e Anatomo-Patologico
La AJCC ha ideato un sistema in cui i melanomi sono suddivisi in base allo spessore (T), allo stato linfonodale (N) ed alla presenza di metastasi a distanza (M). Il sistema attuale è stato aggiornato nel 2010. In base alla prognosi si possono identificare 5 stadi: stadio 0 (melanoma in situ), stadio I (malattia locale), stadio II (malattia locale), stadio III (metastasi ai linfonodi regionali, metastasi in transit o metastasi satelliti), stadio IV (metastasi a distanza). In generale uno stadio maggiormente avanzato è associato ad una diminuzione della sopravvivenza.
Altri Fattori Prognostici
I più importanti fattori prognostici che influenzano la sopravvivenza nei pazienti affetti da melanoma considerati nel sistema di staging della AJCC sono la sede sconosciuta, il microstaging tumorale, l’ulcerazione, lo stato linfonodale e le metastasi a distanza. La presenza di ulcerazione nel melanoma sembra essere associata ad una prognosi peggiore. Il sesso maschile ha una maggiore incidenza di lesioni ulcerate rispetto al sesso femminile (27% contro 19%). Sebbene l’ulcerazione risulti correlata allo spessore del melanoma, la sua presenza sembra essere un fattore prognostico indipendente ed è stato incluso nel sistema di staging. Inoltre, un elevato indice mitotico (maggiore di 1.0), sembrerebbe essere un fattore prognostico indipendente.
Trattamento del Melanoma Primitivo
TUMORI DELLA PELLE NON MELANOMA
Carcinoma Basocellulare e Carcinoma Spinocellulare
Il carcinoma basocellulare o basalioma o epitelioma basocellulare (BCC) e il carcinoma squamocellulare o spinocellulare o epitelioma spinocellulare (SCC) rappresentano il 96 % dei tumori cutanei non melanoma. Questi tumori sono di derivazione epiteliale. Il rapporto tra BCC e SCC è di 4:1 e l’incidenza annuale di BCC e di SCC solo negli Stati Uniti supera il milione di casi. Pazienti affetti da tumori cutanei non melanoma hanno una prognosi eccellente (il 90%-99% è curabile con un appropriato trattamento) e meno dell’ 1 % va incontro ad exitus. Il carcinoma spinocellulare rappresenta il 75 % delle cause di morte tra i tumori non melanoma. Almeno un individuo su due di razza bianca viene colpito da queste neoplasie nell’arco della vita.
Eziologia
Carcinomi basocellulari e spinocellulari sono più frequentemente indotti da una eccessiva esposizione ai raggi ultravioletti del sole o da lampade abbronzanti. Questi tumori sono le neoplasie più frequenti nelle sedi fotoesposte: testa, collo, tronco, arti inferiori, dorso delle mani e regioni estensorie degli arti superiori. I tumori della pelle rappresentano un rischio professionale in persone che lavorano all’aperto. Il fenotipo a maggior rischio è quello con cute chiara che si scotta facilmente, con lentiggini, occhi chiari, capelli biondi o rossi. La melanina cutanea sembra essere un fattore protettivo.
Alcune sindromi genetiche sono associate ad un elevato rischio di sviluppare tumori cutanei non melanoma: la sindrome di Gorlin, lo xeroderma pigmentoso e l’albinismo. La sindrome di Gorlin è un disordine autosomico dominante associato a basaliomi multipli, cavità (pits) palmoplantari, cisti mandibolari, osso frontale pronunciato ed ipertelorismo. L’albinismo è un disordine caratterizzato da un parziale o completo deficit della produzione di melanina e quindi da una perdita di pigmento protettivo. Un altro fattore associato alla comparsa di tumori cutanei non melanoma, soprattutto per il carcinoma spinocellulare, è l’esposizione cronica a sostanze chimiche come arsenico ed idrocarburi (catrami, fuliggine, asfalto). Il fumo di sigaretta è stato associato a spinaliomi delle labbra e del cavo orale. Mentre il papillomavirus umano è stato associato allo sviluppo di carcinomi spinocellulari cutanei delle regioni genitali ed acrali/periungueali. Anche la radiazioni ionizzanti sono state associate ad un maggior rischio di sviluppo di tumori cutanei non melanoma.
Carcinoma basocellulare
E’ la forma più comune di tumore cutaneo. Questi tumori di derivazione epiteliale possono essere suddivisi in vari sottotipi a seconda dell’aspetto clinico, delle caratteristiche istologiche e del comportamento biologico. Sebbene i basaliomi raramente diano metastasi, essi sono caratterizzati da una lenta ma continua invasione locale che comporta una elevata morbilità quando lasciati crescere senza un adeguato trattamento.
L’invasione locale subclinica può essere profonda, estesa e asimmetrica, con diffusione digitiforme di parecchi centimetri oltre ai bordi clinicamente visibili del tumore.
Il sottotipo più comune di basalioma è la varietà nodulare. Questi tumori spesso si presentano come papule perlacee o noduli con telengiectasie. Occasionalmente possono essere pruriginosi o sanguinare. Con il passare del tempo la parte centrale della lesione può ulcerarsi e creare bordi arrotondati; questi basaliomi ulcerati venivano chiamati “ulcus rodens”. Occasionalmente, le lesioni possono essere nodulari e pigmentate e possono essere confuse con un melanoma. Questa variante è stata chiamata basalioma pigmentato. L’istologia di questi tumori è caratterizzata da aree isolate di cellule tumorali basaloidi che nascono dall’epidermide con nuclei periferici a palizzata e retrazione stromale. In alcuni casi i basaliomi possono avere aspetti istologici di metaplasia squamosa con cheratinizzazione. Questi tumori hanno una differenziazione basosquamosa e possono diventare più aggressivi e sviluppare una diffusione linfatica regionale.
Il tipo istologico di basalioma localmente più invasivo è caratterizzato da una modalità di crescita istopatologica aggressiva, ed è conosciuto come basalioma morfeiforme, basalioma sclerosante o cicatriziale. Clinicamente, questi tumori possono avere un decorso subclinico, sono piani e appaiono similcicatriziali. Hanno una significativa incidenza di recidive in quanto le espansioni digitiformi isolate di cellule tumorali basaloidi possono invadere profondamente le strutture circostanti ben aldilà dei margini visibili della lesione. Queste piccole isole di cellule digitiformi possono a volte sfuggire all’esame istologico dei margini e quindi tale verifica deve essere eseguita da patologi esperti.
Clinicamente i basaliomi superficiali sono lesioni squamose, di colorito che va dal rosa al rosso. Frequentemente sono confusi con chiazze di psoriasi o di altre dermatosi squamose o eczematose. Sebbene questi tumori siano di solito relativamente superficiali, è frequente un esteso coinvolgimento subclinico superficiale.
TABELLA 118.8
_______________________________________________________________________________
Carcinoma basocellulare: fattori di rischio più importanti per l’invasione subclinica e la recidiva
- Tumore recidivante
- Sede anatomica
Alto rischio: zona centrale del volto, palpebre, sopracciglio, regione periorbitale, naso, labbra, regione mentoniera, mandibola, regione temporale, orecchio, regione pre o retro auricolare, genitali, mani e piedi.
Rischio medio: guance, regione frontale, cuoio capelluto e collo.
Basso rischio: tronco, estremità (esclusi mani e piedi)
- Dimensioni
Lesioni ≥ 6 mm su aree ad alto rischio
Lesioni ≥ 10 mm su aree a rischio medio
Lesioni ≥ 20 mm su aree a basso rischio
- Sottotipo istologico
Crescita aggressiva (morfeiforme, cicatriziale, sclerosante, infiltrante)
Micronodulare
- Margini mal definiti
- Invasione perineurale
- Sviluppo in regioni cutanee irradiate
- Immunosoppressione
________________________________________________________________________________
La cura è generalmente chirurgica. L’obiettivo deve essere l’asportazione completa del tumore con almeno 1 mm di tessuto sano tra la neoplasia e il margine chirurgico. Questo aspetto può essere solo garantito da un appropriato esame istologico che in situazioni particolari deve essere eseguito a livello intraoperatorio mediante la tecnica dell’esame istologico intraoperatorio al congelatore dei margini, sostanzialmente una versione moderna della tecnica di Mohs. In alcune situazioni particolari se il basalioma è superficiale e di recente comparsa, la chirurgia può essere evitata mediante l’applicazione di trattamenti topici: si può proporre il trattamento topico con creme a base di chemioterpico (5% fluoro uracile) o mediante immunoterapia con imiquimod per 6 settimane. La crioterapia dovrebbe essere evitata come anche il trattamento con laser o diatermocoagulazione, in quanto alterano le caratteristiche della cute impedendo una accurata valutazione della risoluzione della neoplasia. La radioterapia/brachiterapia viene proposta di fronte a situazioni estreme quando lo scopo del trattamento è più di tipo palliativo che curativo.
Una valida alternativa alla chirurgia è rappresentata dall’elettrochemioterapia. Tale metodica ottiene la guarigione del basalioma con una o due trattamenti e viene indicata quando la dimensione e la sede del basalioma causerebbero un danno estetico di difficile riparazione plastica una volta asportata la neoplasia mediante intervento chirurgico. Un esempio può venire da lesioni sulla punta del naso ma anche delle estremità quando la riparazione plastica non potrebbe garantire una riuscita estetica adeguata.
Carcinoma spinocellulare
Il carcinoma spinocellulare è la seconda forma più comune di tumore cutaneo e deriva dai cheratinociti epiteliali. Il carcinoma spinocellulare può profondamente invadere le strutture circostanti e metastatizza più comunemente ai linfonodi regionali. E’ il tumore cutaneo più frequente nei pazienti immunosoppressi trapiantati dove compare dalle 65 alle 250 volte di più rispetto alla popolazione generale. Il carcinoma spinocellulare, nei pazienti immunosoppressi, tende ad avere un comportamento più aggressivo.
Esistono diverse lesioni precancerose che precedono il carcinoma spinocellulare invasivo, le più comuni sono le cheratosi attiniche e il morbo di Bowen (carcinoma spinocellulare in situ ). L’eritroplasia di Queyrat, un’altra lesione precancerosa, rappresenta un carcinoma spinocellulare in situ del glande. Istologicamente il carcinoma spinocellulare mostra una degenerazione maligna di cellule epiteliali con differenziazione verso la formazione di cheratina.
Clinicamente appare spesso come una ferita che non guarisce con ulcerazione e bordi infiammati di colore rosa o una lesione papulonodulare eritematosa ricoperta da una escara cheratosica o da un’ulcera. Le caratteristiche biologiche del carcinoma spinocellulare ne distinguono 3 grandi categorie in base al grading: ben differenziato, moderatamente differenziato e scarsamente differenziato o G 1-2-3. Questi tumori compaiono spesso su cute cronicamente fotodanneggiata o su una cheratosi attinica, ma si possono anche sviluppare su cicatrici da ustione o su ferite infiammatorie croniche. La forma ben differenziata ha una bassa aggressività biologica, spesso si sviluppa in poche settimane ed è sovrastato a volte da una struttura corneificata che lo fa chiamare cheratoacantoma. la terapia è chirurgica e lo scopo è quello di asportarlo con un margine di alcuni mm di tessuto sano attorno alla neoplasia. le forme moderatamente differenziata e scarsamente differenziata presentano una potenziale aggressività biologica che può quindi caratterizzarsi dallo sviluppo di recidive locali o metastasi linfonodali o a distanza. Per tale motivo una volta ottenuta la diagnosi, si procede con accertamenti strumentali di tipo standard come ecografia linfonodale e rx torace e in seguito sulla base di altri parametri come lo spessore di infiltrazione del derma, la presenza di ulcerazione, la dimensione del tumore stesso o il fatto che sia una recidiva dopo precedente asportazione, si propone sia una radicalizzazione della precedente cicatrice con margine di 0.5-1 cm che la biopsia del linfonodo sentinella. Queste lesioni possono essere ampiamente infiltrative. Metastasi ai linfonodi regionali compaiono approssimativamente nell’80-90% dei casi metastatici. Metastasi a distanza come ai polmoni, fegato, cervello, ossa e cute possono comparire nel restante 10-20% dei casi. Carcinomi spinocellulari metastatici comportano una prognosi sfavorevole con una sopravvivenza a 10 dopo per metastasi linfonodali inferiore al 20% e per malattia a distanza del 10%.
Altri Tumori Cutanei
I tumori di frequente riscontro nella pratica clinica sono il carcinoma a cellule di Merkel, il carcinoma delle ghiandole sudoripare ed il dermatofibrosarcoma protuberans ed il sarcoma di Kaposi.
Carcinoma neuroendocrino a cellule di Merkel
Il carcinoma a cellule di Merkel fa parte dei cosiddetti tumori rari, è un tumore maligno neuro-endocrino con caratteristiche di differenziazione epiteliale. Il carcinoma a cellule di Merkel è biologicamente aggressivo, ha un’alta incidenza di recidività locale (36%-50%) di metastasi ai linfonodi regionali (46%-66%) e di metastasi sistemiche (28%).
Sulla base dei dati provenienti principalmente da centri di cura di terzo livello, i tassi di sopravvivenza a 5 anni sono i seguenti: 88% per lo stadio I (senza malattia linfonodale), 60% per lo stadio II (malattia linfonodale regionale), 20% per lo stadio III (malattia metastatica a distanza). Il carcinoma a cellule di Merkel appare come una lesione papulo-nodulare da rossa a purpurea o come una placca indurita e un’associazione ad infezione virale specifica in gran parte dei casi. Circa il 50% di questi tumori insorge nella regione della testa-collo, il 40% alle estremità ed il 10% al tronco. Il carcinoma a cellula di Merkel è un piccolo tumore con immunoistichimica caratteristicamente positiva per CK-20, enolasi neurono-specifica, citocheratine e neurofilamenti. La stadiazione è generalmente indicata per definire l’approccio terapeutico e si avvale di esami ematochimici (enolasi neuronale sierica e beta cromorìgranina che se elevati possono servire come markers della risposta alle terapie) tac o pet total body ed ecografia dei linfonodi locoregionali. Il trattamento consiste nell’ampia exeresi locale con margini di 1-2 cm. La biopsia del linfonodo sentinella (BLS) con colorazione istologica per la CK-20. Il trattamento radioterapico sulla sede del tumore primario può anche essere vagliato. Il ruolo della chemioterapia adiuvante non è attualmente noto pertanto non dovrebbe essere preso in considerazione nei pazienti affetti da metastasi linfonodali operati radicalmente.
Carcinoma eccrino e carcinoma apocrino
I diversi tipi di carcinoma delle ghiandole della cute (sudoripare e sebacee) rappresenta un ampio spettro di neoplasie con rischio variabile di recidiva locale e/o regionale a distanza, queste ultime più comuni in caso di origine eccrina ed apocrina. Ci sono altri tumori rari (0.005% dei tumori della pelle) che hanno diversi sottotipo istopatologici, dando origine ad una nomenclatura varia e confondente. I tipi aggressivi di carcinoma delle ghiandole sudoripare hanno una propensione sia alla recidiva locale e regionale sia a distanza. Clinicamente questi tumori appaiono come placche indurite, papule ovvero noduli comunemente situati nella regione testa-collo od alle estremità e sono di colore rosso, blu, rosa o dello stesso colore della pelle. I sotto-istotipi associati ad un maggior rischio di metastasi regionali linfonodali e sistemiche includono l’adenocarcinoma papillare digitale aggressivo, l’idradenocarcinoma ed il carcinoma eccrino. I trattamenti raccomandati sono l’exeresi ampia del tumore primario, prendendo in considerazione l’effettuazione della biopsia del linfonodo sentinella per le lesioni ad alto rischio, definite come tali sulla base di dimensioni, indice mitotico, indice di crescita ed immunosoppressione. La radioterapia post-operatoria può anche essere presa in considerazione quale trattamento adiuvante.
La diagnosi clinica è pressochè impossibile, ponendosi l’indicazione bioptica in quanto tali lesioni simulano l’epitelioma classico, per poi essere invece confermata dall’esame istologico definitivo.
Dermatofibrosarcoma protuberans
Il dermatofibrosarcoma protuberans (DFSP) è un raro sarcoma dei tessuti molli (1% di tutti i sarcomi dei tessuti molli) con una propensione alla recidiva locale piuttosto che alle metastasi sistemiche. E’ un tumore a cellule fusate che caratteristicamente mostra una immunoreattività per il CD34. Sebbene i soggetti maggiormente affetti siano gli adulti fra la terza e la quinta decade di vita, tuttavia il DFSP può verificarsi anche nei bambini e negli anziani. Questi tumori appaiono come placche fisse, color carne ovvero lievemente rossastro, che possono esser confuse con i cheloidi o con cicatrici ipertrofiche. Sebbene il DFSP possa apparire come lesioni discrete, mostra caratteristicamente un esteso coinvolgimento subclinico, che rende complessa la gestione di questo sarcoma. Istologicamente, questo tipo di sarcoma si caratterizza per la presenza di proiezioni digitiformi delle cellule fusate che probabilmente rendono conto della recidiva tumorale quando non si rispettino margini di resezione relativamente estesi. Il trattamento consiste comunemente nell’ampia escissione con una più precisa definizione dei margini che deve raggiungere i 3 cm nella gran parte dei casi.
Sarcoma di Kaposi
Si distinguono due tipologie di sarcoma di Kaposi, una legata all’infezione da HIV e che colpisce prevalentemente una fascia di soggetti giovani ed una senza infezione da HIV che colpisce persone più anziane, la cosiddetta forma mediterranea.
Il sarcoma di Kaposi è una neoplasia endoteliale, determinata dall’infezione del virus erpetico HHV-8. Caratteristica di questa famiglia di virus è quella di non abbandonare più l’ospite dopo la prima infezione e di annidarsi in un tipo di cellula dell’organismo, causando una cosiddetta infezione latente. Questa si verifica in un tempo variabile a seconda del tipo di virus e della sensibilità dell’ospite. Da tale stato di latenza il virus può riattivarsi, anche dopo molti anni, dando luogo a una recidiva della malattia. Gli stimoli che inducono il “risveglio” dell’attività virale possono essere il caldo, il freddo, i traumi, la febbre, gli stress e soprattutto le variazioni dello stato di difesa immunitaria dell’ospite.
La cura passa dall’intervento chirurgico nelle forme a manifestazione singola alla chemioterapia con caelix 25mg m2 ogni 15 gg all’IFN a basse dosi ai trattamenti con elettrochemioterapia o chemioterapia intralesionale nelle forme variamente avanzate.
Sarcomi dei tessuti molli
I sarcomi sono una delle tipologie di tumori con la più vasta varietà di differenti tipologie istologiche. Si tratta di tumori che possono colpire sostanzialmente qualsiasi organo e tessuto, per cui, più di altri tumori, possono richiedere dal punto di vista terapeutico, la presenza di un team multidisciplinare per essere adeguatamente gestiti. Le forme di cui mi occupo riguardano i sarcomi dei tessuti molli che interessano la cute, il tessuto adiposo (liposarcomi) e muscolare. Non mi occupo di sarcomi ossei.
La maggiore difficoltà che i pazienti affrontano quando vengono colpiti da un sarcoma dei tessuti molli (quindi al di sotto della cute) è la fase diagnostica: si tratta di neoplasie spesso profonde che il paziente tarda ad individuare e di cui si accorge solo quando il volume raggiunto ne permette l’individuazione. La cura nelle fasi iniziali della malattia è quasi sempre chirurgica, sebbene non si possa escludere un approccio medico con chemioterapia preoperatoria nelle forme particolarmente aggressive e localmente avanzate.
La perfusione di un arto
Una modalità terapeutica importante, sebbene non di recente sviluppo, è la perfusione isolata degli arti in circolazione extracorporea: nessun paziente con sarcoma dei tessuti molli di un arto dovrebbe affrontare l’ipotesi di amputazione di un arto senza che prima non sia stata proposta una perfusione. Questo approccio terapeutico consiste nell’isolare chirurgicamente l’arteria e la vena che irrorano un arto e attraverso l’incannulazione degli stessi vasi sanguigni isolati, si isola la circolazione sanguigna dell’arto dal resto della circolazione corporea. Attraverso questo circuito extracorporeo si immette una miscela di farmaci ad una concentrazione 10 volte superiore alla massima dose tollerabile per via sistemica e riscaldando il circuito sanguigno fino a 39-40°C si ottiene un importantissimo sinergismo terapeutico che distrugge elettivamente il tessuto tumorale risparmiando i tessuti sani. Dopo alcune settimane una volta ridotto il volume della neoplasia, si può generalmente procedere chirurgicamente mediante una bonifica del residuo presente nella sede della neoplasia anche per conferma della necrosi tumorale ottenuta con tale trattamento integrato.
Trattamento chirurgico
La biopsia cutanea è importante per la diagnosi prima del trattamento in ogni tipo di tumore cutaneo. Fortunatamente la maggior parte dei tumori della pelle non-melanoma sono lesioni di piccole dimensioni, a basso rischio, che rispondono al trattamento di resezione chirurgica, con tassi di cura del vicini al 100% quando condotti in modo adeguato. I margini per i SCC a basso rischio oscillano tra 0.5 cm e 1 cm. I margini per i BCC a basso rischio oscillano tra 0.1 cm e 0.3 cm. La chirurgia secondo Mohs (cioè la valutazione istologica intraoperatoria dei margini) deve essere presa in considerazione per quegli epiteliomi che, sulla base della sede anatomica, dove l’ampiezza chirurgica deve essere bilanciata dal rispetto delle strutture anatomiche devono essere asportati con un minimo margine chirurgico possibile. La moderna chirurgia di Mohs è indicata mediante l’escissione con attente sezioni e analisi microscopica al congelatore dei margini e con conferma su sezioni definitive. Devono essere sicuramente perseguiti il principio oncologico fondamentale di eliminazione del tumore ed il principio di ricostruzione plastica. Se la sede anatomica non permettesse da subito, in caso di basaliomi, il raggiungimento di margini radicali, si può ripetere l’intervento dopo alcune settimane in modo da permettere ai tessuti di “rielasticizzarsi” e dare l’opportunità al chirurgo di ripetere l’escissione della neoplasia fino all’ottenimento del margine in tessuto sano che deve essere sempre l’obiettivo da perseguire.
Chirurgia secondo Mohs
La chirurgia secondo Mohs è stata sviluppata da Frederick E. Mohs, un chirurgo generale dell’Università del Wisconsin, negli anni ‘40. Inizialmente, una pasta chimica fissativa era applicata sulla pelle per fissare il tessuto in situ; di qui, il vecchio termine di chemochirurgia secondo Mohs, ora in disuso. La tecnica su tessuto fresco, che omette l’uso della pasta chimica, è stata sviluppata e rifinita negli anni 70. La chirurgia micrografica secondo Mohs è la più utile per il trattamento di tumori della pelle non-melanoma ad alto rischio. La chirurgia secondo Mohs è eseguita in anestesia locale in regime ambulatoriale, o a seconda delle situazioni anche in anestesia generale, ma sempre in unità dedicate. Il tessuto asportato viene mappato, codificato con diversi colori che ne definiscono l’orientamento ed inviato al tecnico che processa le sezioni al congelatore. Il campione è flessibile ed appiattito, con il margine smussato di cute periferica posizionato sullo stesso piano orizzontale rispetto al margine profondo. In tale piano, entrambi i margini profondo e periferico vengono esaminati in un unico taglio orizzontale mediante analisi su sezioni congelate con un controllo totale dei margini (teoricamente pari al 100%). La buona qualità delle sezioni congelate può essere ottenuta solo attraverso tecnici di istopatologia abili ed esperti nel campo della preparazione e valutazione istologica intraoperatoria. Il chirurgo che esegue la chirurgia secondo Mohs lavora a stretto contatto col patologo. Dopo la lettura istopatologica delle sezioni congelate, l’esatta localizzazione anatomica di ogni tumore residuo può essere identificata ed il tumore re-escisso, finché i margini di resezione non risultino liberi da malattia. Unico limite alla prosecuzione dell’escissione è legato al tipo di ricostruzione che si renderebbe necessario: se un’asportazione radicale del basalioma implicherebbe un danno estetico di difficile risoluzione, si preferisce aspettare un paio di mesi e riproporre successivamente una chirurgia di completamento. La ricostruzione dei tessuti molli può avvenire nella stessa seduta operatoria, dopo aver completato l’escissione della lesione tumorale. In caso di tumori di grandi dimensioni è necessario un approccio multidisciplinare, che coinvolge chirurghi di diverse specialità (Mohs, plastici, testa-collo, oculo-plastici) ed oncologi radioterapisti. La capacità di eseguire la tecnica chirurgica secondo Mohs è ben rappresentata da una curva ripida di apprendimento.